
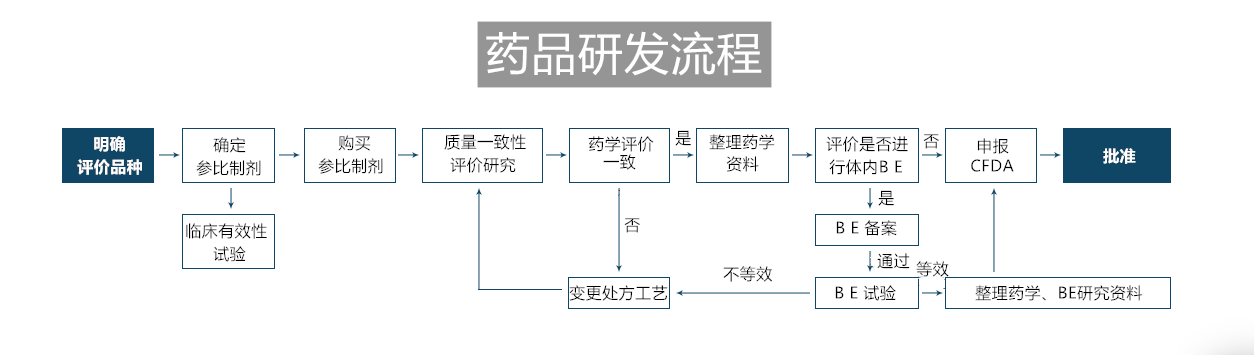
仿制药研发是指按新注册分类的要求,进行仿制药研发,证明与原研药品质量和疗效一致,取得批准文号;仿制药一致性评价是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,重新进行研发和申报,通过药审中心审评。
咨询报价| 化药分析检测 | 微生物检测 | 重金属检测 | 抗生素检测 | 稳定性研究 | 毒理学评价 |
仿制药研发是指按新注册分类的要求,进行仿制药研发,证明与原研药品质量和疗效一致,取得批准文号;仿制药一致性评价是指对已经批准上市的仿制药,按与原研药品质量和疗效一致的原则,重新进行研发和申报,通过药审中心审评。
序列 | 参比制剂和仿制药的质量比对 | 处方工艺二次开发服务 | 药品研发GMP体系建立服务 | 咨询 |
1 | 确定四条溶出曲线的测定条件,测定参比制剂和仿制制剂的溶出曲线,进行溶出曲线的比对 | 需更深入地研究原研制剂的质量 | 专业的工作背景,已成功向FDA和CFDA申报了多个仿制药品种; | |
2 | 确定有关物质、异构体等方法,测定参比制剂和仿制制剂的有关物质、含量、异构体等 | 对原料药的性质进行充分的研究 | 完整的质量保证体系,保证数据的准确性、真实、可追溯和完整性 | |
3 | 研究参比制剂和仿制制剂所用原料药的晶型 | 调整优化处方和工艺,并通过逐级放大确保处方工艺的耐用性 | 高效的工作流程,规范的操作标准,完善的方案和报告模板 | |
4 | 稳定性研究(包括影响因素、加速和长期) | 中试放大/生产技术转移 | 先进的仪器设备,保证项目完成的效率和时间 | |
... | 更多》 | 更多》 | 更多》 | 更多咨询》 |
测试对象 | 质量体系 | 标准方法 | 咨询 |
药品和抗生素类:原料药、药用辅料、各种制剂[包括片剂、胶囊剂、注射剂、颗粒剂、软膏剂等] | 严格按照ISO17025的要求,并参考cGMP和GLP的有关规定 | 各国药典(包括中国药典、美国药典、欧洲药典、英国药典、等)、国家药品标准、中药饮片炮制规范、国家药包材标准、YY类医疗器械行业标准、中国兽药典等 | |
更多》 | 更多》 | 更多》 | 更多咨询》 |
1.资质齐全保障高 |
心邀拥有检验检测机构资质认定(CMA)资质,通过中国合格评定国家认可委员会(CNAS)认可,并严格按照ISO17025体系建设和管理研发实验室、仪器实验室等专业实验室; |
2.仪器先进周期短 |
实验室拥有大量精密检测仪器和各类专业分析设备,满足客户对药品质量的检测,仪器设备实现管理实验数据、实时审计追踪、以及数据结果可追溯性等,确保检测数据准确性; |
3.客户众多服务全 |
心邀专注研发、检测及杂质对照品服务,客户累计众多,其中不乏知名高校、实验室、制药企业等。始终以客户为中心,不断提升综合服务能力,致力于服务全球领域的研究分析、检测平台; |
4.专业规范业务广 |
心邀不仅专注各类医药杂质、环境标品,并提供各项检测(环境检测、中药检测、化药检测、化妆品检测、职业卫生检测等),以及药物研究、动物房试验、备案申报等服务项目。 |